个人防护和医用口罩的欧盟CE认证方法及步骤
CE标志是一种产品安全认证标志, CE代表欧洲统一(Conformite Europeenne)。在欧盟市场CE属强制性认证,符合CE认证的产品就可在欧盟各成员国自由流通。
CE认证适用国家及地区包括奥地利、比利时、丹麦、芬兰、法国、德国、希腊、冰岛、爱尔兰、意大利、卢森堡、荷兰、挪威、葡萄牙、西班牙、瑞典。此外,其他部分国家也承认CE认证。
CE 标示是制造商的符合标志,表示符合所有现行的指令。
欧巿对于CE标志的大小,有包装的规定,其中CE字的高度至少要5mm ,而CE字的长度合计不得超过 12mm,CE字体的宽度,应不少于5分之1。厚度至少要高度的1/5(在此至少要20×1/5=4mm)如图外围半径为10mm, 内围横柱至少要有外围半径之80%(10×0.8=8mm)以当地市场文字印刷之警告及注意事项。制造厂商或授权代理商、进囗商名称、商标及地址。合乎规定之CE.
CE认证机构可以申请的CE认证指令
| 指令号 | 指令名称 | 简称 | 产品范围 |
| 2014/35/EU | 低电压指令CE | LVD | 电子电气 |
| 2014/30/EU | 电磁兼容CE认证 | EMC | 电子电气 |
| 2006/42/EC | 机械指令CE认证 | MD | 机械产品 |
| 305/2011/EU | 建筑建材指令CE | CPR | 建筑产品 |
| 2014/68/EU | 压力容器指令CE | PED | 压力容器 |
| 2016/425/PPE | 个人防护指令CE | PPE | 个人保护装置 |
| 93/42/EEC | 医疗器械CE认证 | MDD/MDR | 医疗方面设备 |
| 2014/34/EU | 防爆指令CE认证 | ATEX | 易燃易爆环境用途 |
| 2014/53/EU | 无线电与通讯CE | RTTE | 含有无线模块设备 |
| 2013/53/EU | 娱乐游艇指令CE | Boats | 游艇,娱乐设备 |
| 2014/33/EU | 电梯指令CE认证 | LIFT | 电梯设备 |
这里主要介绍上面划红线的部分,个人防护口罩和医用口罩的CE认证方法和步骤。
欧盟口罩分类
欧盟口罩主要分为个人防护口罩(PPE)和医用口罩,其中个人防护口罩依据标准EN149,防护的风险由低到高又分为FFP1、FFP2、FFP3三个类别;医用口罩按照一类医疗器械管理,分为I类非无菌口罩和I类无菌口罩,依据标准EN14683,其BFE、呼吸阻力和防喷溅能力不同又分为Type I、Type II、Type IIR三个类别。
| 口罩分类 | 监管法规 | 执行标准 | 防护等级 |
| 个人防护口罩PPE | Regulation EU 2016/425:欧盟个人防护用品法规 | EN 149 | FFP1:最低过滤效率≥80%
FFP2: 最低过滤效率≥94% FFP3: 最低过滤效率≥97% |
| 医用口罩(非无菌和无菌) | MDD 或MDR:欧盟医疗器械法规 | EN14683 | Type I:BFE≥95%,血液穿透无要求
Type II:BFE≥98%,血液穿透无要求 Type III:BFE≥98%,血液穿透≥16Kpa(120mmHg) |
欧盟口罩监管法规
个人防护口罩适用法规为欧盟个人防护用品法规(EU 2016/425),依据法规要求,出口欧盟的个人防护口罩必须先通过授权的公告机构认证。
医用口罩适用法规为欧盟医疗器械指令(MDD)或医疗器械法规(MDR),根据规定,2020年5月26日之后,医用口罩认证将强制要求符合医疗器械法规MDR的要求进行认证。
欧盟口罩认证流程
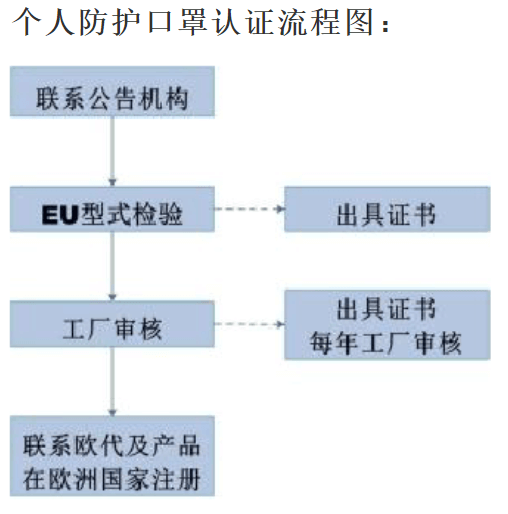
1. 个人防护口罩
| 认证流程 | 备注 |
| 1. 提供申请表、产品实物图片及说明书 | 发证机构提供申请表 |
| 2. 准备产品型式实验报告 | 依据EN149检测,检测项目包括:外观、材料、阻燃测试、头带、呼气阀、预处理、呼吸阻力、漏气系数、二氧化碳浓度、实际佩戴。 |
| 3. 技术文件评审 | 发证机构评审 |
| 4. 工厂质量体系审查 | 发证机构评审工厂体系资料 |
| 5. 发证机构颁发CE-PPE证书 | 有PPE发证能力的发证机构评审并发证 |
个人防护口罩认证的难点及风险点
1) 按防护类产品进行CE认证需要产品EU型式检验和公告机构审核,需要考虑检测周期和审核时间,目前我们所了解的几家认证机构给出的时间均在2个月以上。
2) 国内的防护口罩的检测报告并不能完全覆盖EN149的要求,因此企业需要按照EN149的要求重新检测,而且只能选择有资质的单位进行检测,否则报告被认为是无效的。
3) 作为PPE认证的产品,在写产品的用途、设计标签和说明书时一定要考虑产品的范围,不能随便写Medical mask。产品的说明书以及标签如果超出产品的认证范围,注册时有风险。
4) 企业在选择认证途径时一定考虑产品的市场,在欧洲个人防护用品和医用商品的销售途径不同,个人防护用品很难进入药店和医疗机构的。
5) 关于PPE产品,目前市面上很多86/866/EEC的证书,该法规已经取消,所以此类的证书也是无效的,产品无法销售欧洲。
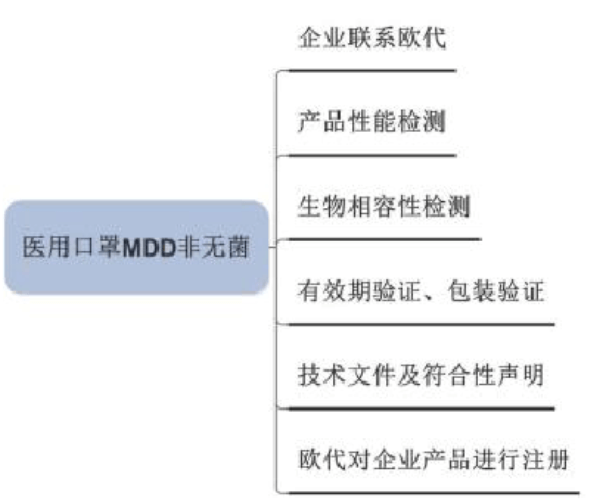
2.非无菌医用口罩
| 认证流程 | 备注 |
| 1. 编制技术文档(TCF) | 发证机构提供申请表 |
| 2. 准备测试报告 | 依据EN14683要求检测,或提供熔喷布性能测试报告和无纺布生物学测试报告 |
| 3. 编制自我符合性声明(DOC) | |
| 4. 指定欧盟授权代表提交备案 | 指定的欧盟授权代表在其所在国提交备案 |
| 5. 发证机构颁发CE证书 | 有发证能力的发证机构评审并发证 |
3.无菌医用口罩
| 认证流程 | 备注 |
| 1. 建立ISO 13485质量管理体系 | |
| 2. 编制技术文档(TCF) | 发证机构提供申请表 |
| 3. 准备检测报告 | 依据EN14683要求检测,主要提供生物学常规三项、细菌过滤效率、呼吸阻力、防溅阻力及灭菌验证报告等 |
| 4. 公告机构审核 | |
| 5. 获得ISO13485证和CE证书 | |
| 6. 指定欧盟授权代表完成注册 | 由指定的欧盟授权代表提交注册 |
医用口罩认证的难点及风险点:
1) MDD Class I自我符合性声明途径是I类医疗器械认证的法定途径,这是欧洲法规不容质疑。针对目前第三方机构发放的符合性声明,请企业一定要确认符合性声明上写的产品标准是否为欧洲标准;如果不是,产品可能会出销售的问题。
2) 根据MDD,自我符合性声明是要企业严格进行临床前评估和临床评价的,因此产品安全性和有效性的检测必须符合欧洲的标准:EN14683或EN149。
3) 对于目前国内按国标检测的产品,按照欧洲的要求应该需要重新进行检测,但欧洲对性能检测的机构的资质并没有要求,检测的报告的合规性主要看检测方法以及检测的Criteria是否符合要求。
4) 目前国内企业想短期内在欧洲进行产品注册,实现这一目的的前提是:有成品/原材料的生物相容性报告,在具备性能检测设备或相应的工厂、实验室进行产品性能检测,完成产品的老化测试(如果有效期为2年,老化测试的时间2个月左右)及包装验证。
5) 不管在欧洲哪个国家注册,对产品的标签和说明书都是有相应的要求的,因此在企业考虑CE认证之前请联系欧代,让欧代提供产品标签和说明书的要求。
欧盟口罩快速认证建议
鉴于国内新建立的口罩企业,在应对医疗器械行业法规存在一定的难度,加之口罩检测容量受限,瑞旭集团建议口罩企业在采购原材料时向供应商索取熔喷布和无纺布的正规检测报告,选择认证机构时先从欧盟官网查询其发证机构是否被授权认证资质,分阶段完成口罩出口欧盟认证,先申请个人防护口罩认证,同时准备非无菌医用口罩欧盟认证甚至无菌医用口罩欧盟认证,确保能快速获得口罩欧盟认证并快速出口欧盟。
SGS快速CE认证方案:医疗器械第一类非灭菌
(1)产品检测:如果已有检测报告可直接使用,EN14683/or GB19083/ or YY0469/ or YY/T0969。
(2)出具CE符合性声明证书:客户需提交测试报告,1周出声明证书,有了声明,客户就可以走货。
- 口罩产品相应的技术文档。
- 全项目Pass EN14683/or GB19083/ or YY0469/ or YY/T0969 测试报告,报告需要由SGS出具,或者由ISO 17025 实验室出具(报告中可以没有ISO17025 logo)--指CNAS等资质。
- 生物兼容性报告,比如ISO 10993,,报告需要由SGS出具,或者由ISO 17025 实验室出具(报告中可以没有ISO17025 logo—指CNAS等资质。
- 生产许可备案文件、营业执照。生产许可备案文件、营业执照需要涵盖医用口罩的范围。
- 非灭菌口罩生产车间需要达到30万级净化要求。
(3)工厂审核:SGS 出具声明后再进行ISO13485工厂审核(客户可以先走货)。
Say Something!